
CJ제일제당 BIO사업부
기술마케팅팀 부장 김양수
1. 핵산(Nucleotide)이란?
동물영양학자들 사이에 핵산(Nucleotide)이라는 영양소에 대한 정보는 비교적 잘 정립되어 있는 반면, 실제 사료기술자들에 있어서는 아마도 생소한 단어일 것이다. 우선 그 단어에서부터 왜 핵산을 흔히들 알고 있는 ‘nucleic acid’라 하지 않고, ‘nucleotide’라 하는 것인지조차 조금은 의아해 할 것으로 생각된다. 우리가 알고 있는 핵산 즉, 유전학에 있어서 핵산(nucleic acid)이라 함은 유전학 또는 분자생물학 전공자가 아닐지라도 누구나 한번쯤은 들어 본적이 있는 DNA, RNA와 같은 것을 연상할 것이다. 그러나 필자가 오늘 이야기하고자 하는 ‘nucleotide’는 국문으로는 정확한 표현이 없어, 여러 논문에 표현된 ‘핵산관련물질’을 축약하여 ‘핵산’이라는 표현을 사용하고자 한다. 실제 핵산이라는 표현은 동물영양학 보다는 식품 첨가물 분야에서 범용적으로 사용되는 용어에 가까울 것이나, 실제 식품용 제품을 사료용으로 이용 가능하게 된 현 시점에서 기존에 사용하던 용어를 그대로 차용하여 사용하고자 한다.
2. 핵산의 구조
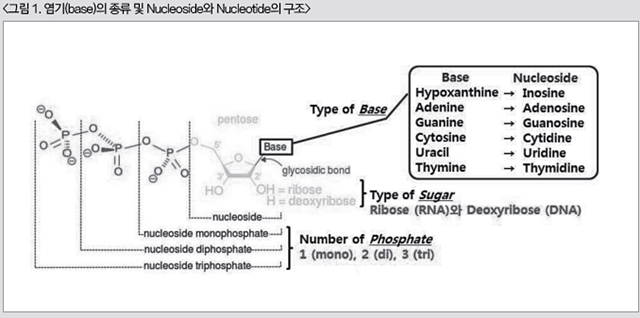
핵산의 구조를 이해하기 위한 첫 단계로, nucleoside, nucleotide 그리고 nucleic acid 간의 형태적 차이를 이해할 필요가 있다. 사료용 핵산의 가장 기본단위인 Nucleoside는 다양한 형태의 염기(base)에 5탄당(pentose sugar)이 결합(glycosidic bond)된 구조이다. Hyposanthine, Adenine, Guanine, Cytosine, Uracil 그리고 Thymine 등과 같은 염기는 5탄당과 결합되면서 각각 Inosine, Adenosine, Guanosine, Cytidine, Uridine 그리고 Thymidine으로 이름이 바뀌면서 nucleoside로 불리게 된다. 한편 5탄당의 2번째 탄소와 결합되는 분자의 종류에 의해서도 수산기(OH)가 결합되면 RNA의 기본골격이 되는 ribose로, 수소(H)가 결합되면 DNA의 기초가 되는 deoxyribose로 전환된다.
이렇게 염기와 5탄당이 결합된 nucleoside 구조물에 인산염 (phosphate)이 결합(high energy phosphate bond)된 것을 본 장에서 중심으로 소개하고자 하는 nucleotide가 된다. 단, 결합된 phosphate의 개수에 따라 인산염의 이름 앞에 Greek number가 붙게 되는데, 인산염이 하나일 경우 mono를, 둘일 경우 di 그리고 셋일 경우 tri가 붙게 된다. 흔히, 생명체를 가동시키는 화학에너지로 알려진 ATP는 Adenosine Tri-Phosphate의 앞 글자만 따서 부르는 것을 말하며, 굳이 문장으로 풀어서 설명하면 ‘Adenosine (Adenine의 nucleoside형태)에 3개의 인산기가 붙은 nucleotide’라 할 수 있다(그림 1).
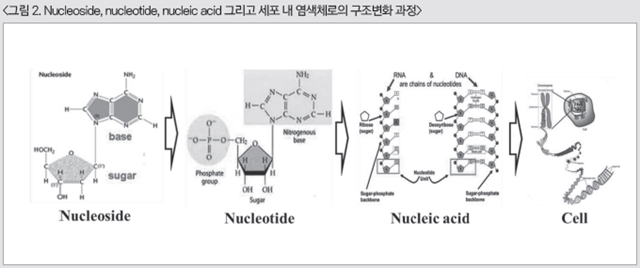
이렇게 염기, 5탄당 그리고 인산염이 결합하여 완성된 nucleotide들은 서로간의 결합하여 nucleic acid를 형성하게 되며, 5탄당(deoxyribose, ribose)과 염기(AMP, GMP, TMP, CMP, UMP)의 종류에 따라 DNA (deoxyribose nucleic acid) 또는 RNA (ribose nucleic acid)를 형성하게 된다. 이렇게 수많은 핵산(nucleotide)이 결합된 DNA와 RNA는 각각 유전형질을 갖는 세포의 염색체(chromosome)를 구성하거나 리보솜(ribosome)에서 아미노산과 결합하여 수많은 종류의 단백질을 합성하게 된다(그림 2).
3. 핵산의 종류
앞서 이야기한 핵산의 종류를 이해하기 위해서는 우선, 가장 기초물질이자 핵산의 구분 및 기능성의 근본이 되는 물질인 염기의 종류와 구조에 대해 이해할 필요가 있다. 핵산은 통상적으로 염기의 구조에 따라, purine계 핵산과 pyrimidine계 핵산으로 구분된다. 이들 사이의 차이는 분자 구조식을 보면 그 형태적 차이를 쉽게 이해할 수 있다(그림 3).
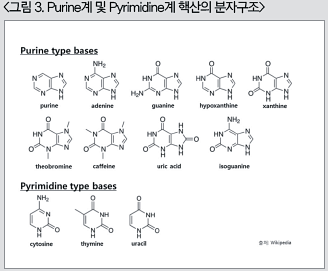
그림 3에서와 같이 purine계 핵산과 pyrimidine계 핵산 사이에 가장 큰 분자구조식의 차이는 헤테로 고리(heterocycle)에 결합되어 있는 이미다졸 고리(imidazole ring)의 결합유무이다. 즉, 헤테로 고리에 이미다졸 고리가 결합되어 있는 염기가 5탄당과 결합(glycosidic bond)되어 있으면 purine계 핵산으로, 이미다졸 고리 없이 5탄당과 직접 결합되어 있으면 pyrimidine계 핵산으로 구분한다. 즉, purine은 pyrimidine에 비해 생리대사에 필요한 탄소와 질소원자를 상대적으로 더 함유하고 있는 분자구조를 갖고 있으며, 이들의 체내합성시에는 어떠한 원료들로부터 탄소와 질소원자들의 공급이 필요함을 의미한다. 특히, 염기에 함유된 질소의 경우 순수 단백질함량에는 관여하지 않는 비단백태 질소의 형태로 존재하게 되는데, pyrimidine계 핵산의 경우, 함성에 필요한 질소를 아스파르트산(aspartic acid)으로 부터 공유 받는 반면, purine계 핵산의 생합성에 필요한 질소 원자들은 아스파르트산(aspartic acid)과 함께 글루탐산염(glutamate)과 글리신(glysine)으로부터 공급 받는다. 아스파르트산과 글루탐산염은 모든 가축에서 비필수 아미노산에 해당하는 것으로 분류되나, 이들 아미노산들은 에너지 생성 및 신경전달 물질로서의 기능과 함께 여러 필수 아미노산 생성에 중요한 역할을 하는 것으로 알려져 있다.
한편, 글리신은 양계에서 필수 아미노산으로 분류되고 있으며, 다른 필수아미노산인 쓰레오닌의 전구체로서의 기능뿐만 아니라 메티오닌(methionine)을 시스테인(Cysteine)으로전환하는 등, 영양생리학적으로 중요한 역할을 담당하고 있다. 그리고, 최근 축산 사료업계에서 일반적인 트랜드로 자리잡은 사료 내 아미노산 균형조절에 의한 조단백질(crude protein; CP)함량 저감동향과 관련하여, 글리신의 영양학적 중요성은 새로이 주목 받고 있다. 실제로 양계사료에서 CP함량이 20%이하로 낮아질 경우, 양계에서의 필수아미노산인 글리신 첨가가 우선적으로 고려되어야 할 것으로 보고 있다.
즉, 사료를 통해 핵산이 충분히 공급되지 않았을 경우, 핵산 자체의 생리적 기능성 감소와함께, 핵산의 체내 합성에 필요한 아미노산들의 영양학적 효율 또한 떨어지게 되므로, 사료 내 핵산함량에 대한 문제인식은 기존의 에너지가 및 단순 단백질함량 그리고 필수아미노산 함량 등과 함께 추가적으로 고려하여야 할 영양소 중 하나일 것이다. 그러나, 경제적이며 효율적인 사료배합 비를 설정함에 있어 모든 필수아미노산이 필요하지 않듯이, 핵산에 있어서도 모든 핵산이 전부 필요하지 않고 특정 핵산에 대한 과부족과 함께 체내 대사경로에 있어 필요한 핵산에 대한 이해가 수반되어야 할 것이다. 이와 관련 하여 다음 장에서 살펴보고자 한다.
4. 핵산의 생합성 및 대사경로
앞서 언급한 바와 같이, 핵산은 체내에서 필요량이 합성이 되는 비필수 영양소이다.
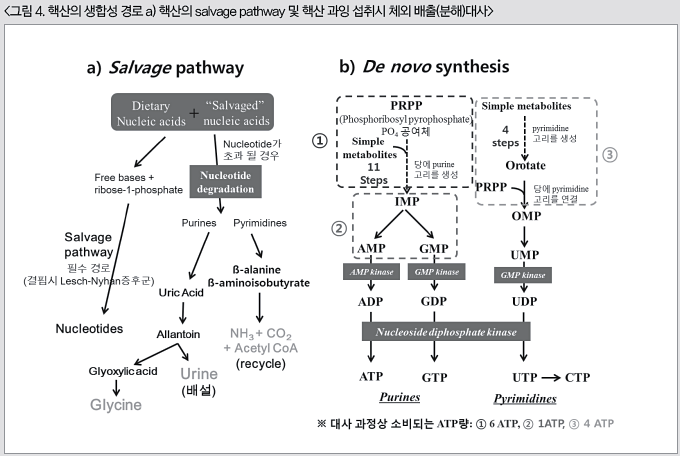
그러나, 성장 초기단계(어린시기) 또는 스트레스(사육환경의 변화, 질병, 상처, 핸들링, 낮은 핵산함량의 사료공급)조건일 경우, 빠른 성장 및 기관발달 그리고 항상성 유지에 필요한 핵산요구량은 증가하게 된다. 이때, 먹이로부터 충분한 양의 핵산이 공급되지 못할 경우, 성장 및 유지에 필요한 핵산을 합성하기 위한 질소와 탄소의 동원이 필요로 하게 되어, 체내 단백질축적 및 지방산 합성(전환)에 필요한 질소나 탄소 원자의 효율적인 이용이어려워진다. 반면, 핵산요구량이 높아진 시기에 외부로부터 충분한 양의 핵산이 공급될 경우, 체내 대사유지 및 성장에 필요한 핵산 요구량을 만족시켜 줌과 동시에 핵산 합성에필요한 영양소의 동원대사가 필요 없게 된다. 즉, 핵산의 생합성에는 체외 먹이로부터 공급되는 salvage pathway와 체내 영양소로부터 조합하여 생합성 하는 de novo synthesis모두가 영향을 미치며, 이 합성경로 간의 상호조화를 통해 체내 핵산요구량은 충족되게 된다. 이 두 종류의 합성경로 중, de novo합성은 체내에 이미 존재하는 핵산함량에 의해조절되므로, salvage pathway에 의한 핵산의 공급은 denovo합성에 의한 핵산의 생합성경로를 조절하게 된다. 특히, purine계 핵산의 경우 필요량의 약 90%가 salvage pathway경로를 통해 공급된다.
그림 4의 a에서 보이는 것과 같이, 먹이를 통해 흡수된 nucleoprotein 또는 nucleic acid는여러 소화효소들에 의해 nucleotide / nucleoside / base로 소화/흡수되어 체내에 염기 pool를 구성한다. 이때, nucleotide가 과잉 섭취될 경우, purine과 pyrimidine 사이에 서로다른 대사경로를 통해 체외로의 배설 또는 체내에서 재활용 된다. 우선, purine의 경우base가 요산(uric acid)으로 전환된 이후, 간의 요산염 산화효소(urate oxidase)에 의해allantoin으로 분해되고 다시 여러 효소들에 의해 글리옥실산(glyoxylic acid)과 요소(urea)를 합성한다. 합성된 요소는 오줌을 통해 체외로 배설되고, 글리옥실산은 세포 내 세포질액(cytosol)과 미토콘드리아(mitochondria)에서 양계의 필수 아미노산인 글리신
(glycine) 합성에 이용된다. 반면, pyrimidine의 경우에는 유리염기인 uracill과 thymine으로 전환된 이후 β-alanine과 β-aminoisobutyrate를 합성하고, 최종적으로 NH3,CO2그리고 Acetyl CoA가 합성되어 다시 primidine 재합성에 이용된다.
그러나, 사료 내에 핵산함량이 부족하여 salvage 합성을 통한 핵산공급이 요구량을 만족하지 못할 경우, 그림 4의 b에서 보이는 것과 같이 de novo 합성경로에 의한 핵산공급이 이루어진다. 이러한 핵산합성경로는 purine과 pyrimidine 사이에 크게 차이가 있다. purine의 경우, ribose-5-phosphate로부터 purine계 핵산의 가장 기본물질인 IMP (Inosine-5`-
monophosphate)를 합성하기 까지 총 11단계의 생합성 과정을 거치게 되고, 이 과정에서 6개의 ATP를 소모하게 된다. 결과적으로 생성된 IMP는 다시 AMP와 GMP로 체내에서 전환하게 되고 이들은 각각 인산염과 결합하여 AMP는 ADP를 거쳐 ATP로, GMP는 GDP를 거쳐 GTP로 각각 전환된다. 그리고 IMP에서 GMP로 전환시에 또 하나의 ATP가 사용되어, de novo합성을 통한 IMP와 GMP의 체내합성에 있어서는 6개 또는 7개의 ATP를 각각 소모하게 된다. 한편, pyrimidine의 합성경로는 비교적 단순해서, 글루타민(glutamine)으로부터 유래한 NH3과 CO2가 효소작용에 의해 carbamoyl phosphate를 형성하는 반응으로부터 시작하여 pyrimidine핵산의 기본물질인 OMP (Orotidine Mono Phosphate)를 만들기까지 4단계의 대사과정을 거치는데 여기에는 purine합성경로에서보다 적은 4개의 ATP를 소모하게 된다. 합성된 OMP는 효소반응에 의해 UMP로 전환되며, 인산화에 의해 UMP → UDP → UTP로 전환된다. 최종적으로 UTP는 CTP synthetase에 의해 CTP가 되어 체내에서 이용된다.
즉, purine과 pyrimidine모두 세포의 대사에 있어 중요한 물질임에는 틀림없으나, 체내 핵산 생합성에 필요한 에너지(ATP) 소비와 대사시간을 고려하면 먹이를 통해 우선적으로 공급되어야 하는 핵산은 pyrimidine계 핵산보다 IMP와 GMP와 같은 purine계 핵산이 더 우선 순위에 있음을 알 수 있다.
5. 사료원료 별 핵산함량
핵산의 최초 개발역사가 식품첨가물에서 유래한만큼, 식품원료들에서의 핵산함량은 대체적으로 분석이 잘 되어있는 편이다. 반면, 사료 원료의 핵산함량에 대한 정량분석은 비교적 그 자료가 적으며, 같은 원료라 할지라도 샘플들 간의 함량차이가 크다.
그러나, 대부분의 분석결과들은 공통적으로 식물성원료에 비해 동물성 원료에서 핵산함량이 높은 것을 관찰할 수 있다. 그 이유로는 식물세포와 동물세포 간의 크기와 구조적인차이에서 기인하는데, 셀룰로스, 펙틴, 리그닌 등으로 구성된 두꺼운 세포벽(cell wall)을 갖는 식물세포에 비해, 지질, 단백질, 탄수화물 등으로 구성된 비교적 얇은 세포막(cell
membrane)을 갖는 동물세포에서 단위 중량 당 핵산함량이 높은 것은 당연한 결과일 것이다. 하나의 참고문헌의 결과를 발췌하여 보이면, 식물성 및 동물성 사료원료 들간의 핵산함량의 차이를 여실히 보여준다(표 1) .
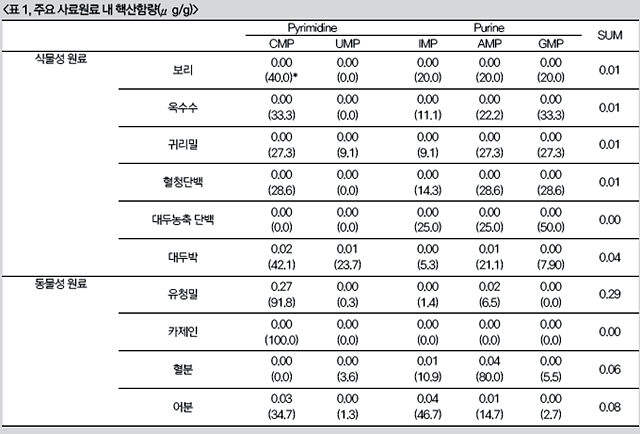
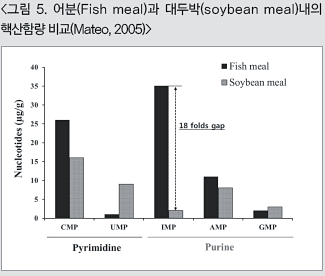
이러한 동물성 및 식물성 사료원료들 간의 핵산함량 차이는 축·수산동물의 자연상태의 먹이에 가까운 일반적인 사료 배합비의 섭취환경에서는 크게 문제될 것이 없다. 그러나 점차 늘어나는 동물성 원료가격의 상승에 따른 식물성 원료로의 대체는 핵산공급의 측면에서는 큰 차이를 유발할 가능성이 크다. 실제로 표 1을 바탕으로 가장 많은 대체가 이루어지고 있는 어분과 대두박의 경우를 보면, 핵산의 종류별 함량차이를 더욱 확실히 보여준다(그림 5). 우선, pyrimidine계 핵산의 경우 CMP에서는 어분과 대두박 사이에 다소 차이를 보이고 있으나, pyrimidine계 핵산의 기초물질인 UMP의 경우에 있어서는 대두박이 어분보다 높은(약 9배)함량으로 관찰된다. 한편, purine계 핵산의 경우 AMP와 GMP에서 어분과 대두박의 차이는 미미하나, purine계 핵산의 기초물질인 IMP에서는 두드러진 차이(약18배)를 보이고 있다. 즉, 대두박에 의한 어분대체의 관점에서 보면 필연적으로 purine계 핵산, 특히 IMP의 공급부족을 유발하게 되는 것이다.
한편, 참고문헌9에서 인용한 위의 data는 각각의 원료별 인산기가 붙은 nucletoide의 형태의 핵산함량만 보여주고 있다. 그러나, 실제적으로 체내에서 핵산의 흡수는 대부분nucleoside 또는 base형태로 흡수되며 nucleic acid와 nucleotide 형태는 약 10%미만으로 흡수된다. 흡수된 nucleoside와 base는 체내에서 쉽게 nucleic acid와 nucleotide 형태로전환되어 이용되므로 사료원료에 있어 핵산함량 평가는 base형태에서부터 nucleic acid형태까지 일련의 핵산함량을 통합하여 보여주는 것이 옳을 것이다.
표 2는 저자가 소속된 연구소에서 사료내 주요 단백질원료당 핵산함량 분석치를 보여준다. base와 nucleoside 값을 핵산 함유량으로 묶어 표현한 값으로 앞서 참고문헌에서의 분석치 보다는 높은 값을 보인다. 즉, nucletotide단독 함량분석을 통한 원료내의 핵산 함유량을 유추해서는 정확한 각각의 핵산함유량을 산정할 수 없음을 의미한다.
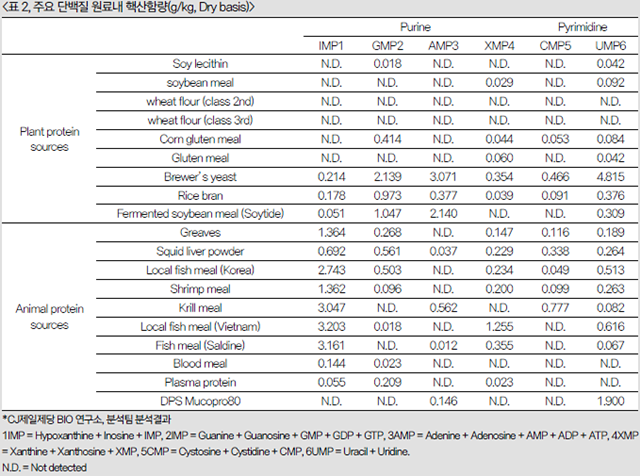
그럼에도 불구하고, plasma protein을 제외한 대부분의 동물성 원료에 있어 높은 핵산함량 갖고 있음을 알 수 있으며, 특히 모든 종류의 어분에 있어서 공통적으로 IMP가 높은 것을 확인할 수 있으며, 이에 반해 어분대체 원료인 대두박에 있어서는 매우 낮은 값이 검출되어 앞선 참고문헌과 동일한 경향이 관찰되었다.
아울러, 효모(yeast)와 Bacillus균을 이용하여 발효 생산된 발효 대두박(fermented soybean meal)에 있어서는 어분과 높거나 유사한 함량의 핵산 함량을 갖고 있었다. 이것은 효모(yeast)와 Bacillus균총 자체의 핵산함량일 것으로 생각된다. 이렇듯 사료원료에 있어 각각의 함유 영양소에 대한 정보는 현재의 발달된 사료배합기술에 있어서 가장 전제되는 필수조건 중 하나이며, 지금부터라도 사료 원료별핵산 함유량에 대한 정보는 함께 공유되어 사료 내 정확한 핵산 함유량 설정을 위해 이바지 해야 할 것이다.
그러나, 아직까지 국내 공인분석기관들 중 사료원료 또는 사료 내 핵산함량을 염기단위까지 분석할 수 있는 기관은 그리 많지 않은 점이 가장 큰 걸림돌로 존재한다. 식품분야에서활용중인 분석기법을 도입에 의한 사료분야에서 분석항목의 다양화가 필요한 시점이다.
<다음 호에 계속>
<월간 피그 8월호>





